Réalisation et étude d’une pile
I.
Réalisation
d’une pile cuivre-zinc :
1.
Expériences préliminaires : Réaliser les deux
expériences suivantes en parallèle :
|
Réaction entre les ions une solution de sulfate de
cuivre et du métal zinc §
Mettre
une spatule de poudre de métal zinc dans un tube à essais §
Ajouter
environ 2mL de solution de sulfate de cuivre II §
Agiter
|
Réaction entre les ions une solution de sulfate de
zinc et du métal cuivre §
Mettre
un morceau de tournure de cuivre dans un tube à essais §
Ajouter
environ 2mL de solution de sulfate de zinc §
Agiter Observations :
|
Conclusion :
2.
But de la réalisation d’une pile :
Empêcher
le transfert direct d’électrons en les faisant passer par un chemin extérieur à
la solution.
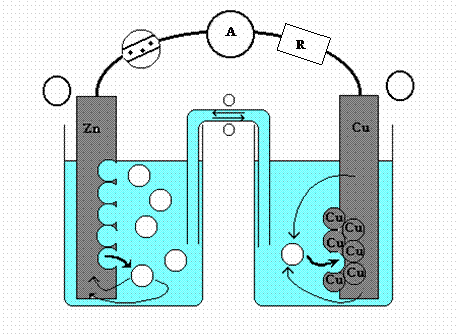
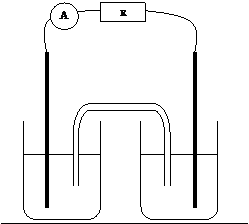
3.
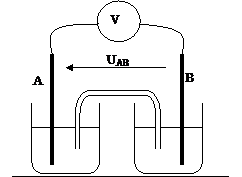
Montage :
|
§
Définir
ce qu’est une demi-pile : §
Rôle
du pont salin : (Le pont salin entre deux piles est assuré par une solution
de chlorure de potassium) §
Porteurs
de charge dans le pont salin ? Dans les fils de connexion ? |
|
§
Compléter
le schéma en indiquant le sens du courant et les pôles de la pile.
4.
Modélisation de la transformation chimique ayant lieu dans
la pile :
§
Donner
les couples oxydant/réducteur en jeu et écrire les équations des réactions qui
ont lieu dans chaque demi pile. Identifier la demi pile siège d’une oxydation
et celle qui est le siège d’une réduction. Préciser la nature et la polarité
des lames.
|
Demi pile |
Couples |
Equations |
Type de transformation |
Nature et polarité de la lame |
|
Cuivre |
|
|
|
|
|
Zinc |
|
|
|
|
§
En
déduire l’équation de la réaction chimique globale qui a lieu dans la pile.
Comparer avec la réaction de la manipulation 1.
Bilan :
§
Pour
chaque demi pile, préciser l’évolution des concentrations des ions et des
masses des lames :
|
Cuivre |
|
|
|
Zinc |
|
|
§
Calculer
le quotient de la réaction initiale Qr,i en
utilisant les concentrations de Cu2+ et Zn2+ dans chaque
bécher.
§
La
réaction globale de la pile possède une constante d’équilibre égale à 1036.
La transformation globale de la pile suit-elle le critère d’évolution d’un
système chimique ?
5.
Schématisation de la pile :
La
pile réalisée précédemment peut être schématisée de la façon suivante :
- Zn(s)/Zn2+(aq)//Cu2+(aq)/Cu(s) +
II. Facteurs influençant la fém d’une pile :
1.
Tension aux bornes de la pile et Force électromotrice d’une
pile :
On remplace l’ampèremètre par un voltmètre qui mesure la tension aux bornes de
la pile.
§
Que peut-on dire
de l’intensité du courant débité par la pile quand le voltmètre est placé entre
ses pôles ? Quelle grandeur caractéristique de la pile mesure-t-on
alors ?
|
§
Indiquer
sur le schéma les bornes COM et V du voltmètre qui permet de mesurer la tension
UAB. §
Rappel :
Définition de la tension électrique : UAB
= VA – VB |
|
2.
Influence des couples mis en jeu :
Réaliser
les demi-piles suivantes, en utilisant des solutions de même concentration (C=10-2mol.L-1):
- Demi pile au cuivre: Lame de cuivre dans solution
de sulfate de cuivre
- Demi-pile au zinc: Lame de zinc dans solution de sulfate
de zinc
- Demi-pile au fer: Lame de fer dans solution de
sulfate de fer
Précautions:
chaque bécher doit contenir le même niveau de solution pour éviter le phénomène
de siphon
Manipulation et Mesures:
§
Réaliser
les piles figurant dans le tableau suivant
§
Indiquer
les bornes COM et V du voltmètre permettant de mesurer la tension indiquée sur
le schéma.
Réaliser la mesure.
§
En
déduire laquelle des électrodes est la cathode (pôle +) et laquelle est l’anode
(pôle -)
§
En
déduire les demi équations qui ont lieu à chaque électrode
§
Donner
la valeur de E la fem de la pile
|
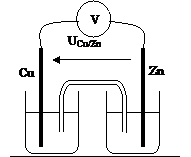
Cuivre – Zinc
|
UCu/Zn = |
E = |
|
Cathode : |
|
|
|
Anode : |
|
|
|
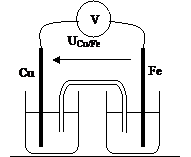
Cuivre – Fer
|
UCu/Fe = |
E = |
|
Cathode : |
|
|
|
Anode : |
|
|
|
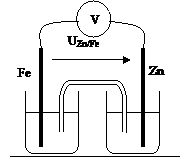
Fer – Zinc
|
UZn/Fe = |
E = |
|
Cathode : |
|
|
|
Anode : |
|
|
|
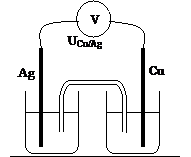
Cu –
Argent
|
UCu/Ag = |
E = |
|
Cathode : |
|
|
|
Anode : |
|
|
|
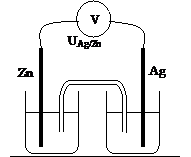
Argent – zinc
|
UAg/Zn = |
E = |
|
Cathode : |
|
|
|
Anode : |
|
3.
Influence des concentrations :
Réaliser
les demi piles suivantes :
- Demi pile au cuivre: Lame de cuivre dans solution
de sulfate de cuivre (C=10-2mol.L-1)
- Demi pile au zinc: Lame de zinc dans solution de
sulfate de zinc (C=10-2mol.L-1)
- Demi pile au cuivre: Lame de cuivre dans solution
de sulfate de cuivre (C=10-3mol.L-1)
- Demi pile au zinc: Lame de zinc dans solution de
sulfate de zinc (C=10-1mol.L-1)
§
Réaliser
les piles figurant dans le tableau suivant
§
Mesurer
la fem E de chaque pile (on rappelle que Cu est la cathode de la pile)
|
Pile |
Concentration solution Cu2+ |
Concentration solution Zn2+ |
E (V) |
|
Cuivre – Zinc |
10-2mol.L-1 |
10-2mol.L-1 |
|
|
Cuivre – Zinc |
10-3mol.L-1 |
10-1mol.L-1 |
|
§
Conclusion
§
Application :
évolution de la fem d’une pile au cours de son
fonctionnement
Remplir le tableau suivant :
|
Avancement de la réaction de fonctionnement |
Evolution de la concentration en ion Cu2+ |
Evolution de la concentration en ion Zn2+ |
Evolution de E |
|
x=0 |
|
|
|
|
0 < x < xf |
|
|
|
|
xf |
|
|
|
III. Intensité débitée par la pile cuivre-zinc :
1.
Manipulation :
§
On
réalise le circuit correspondant au schéma du montage établi en I.3., pour
lequel R=27Ω
On donne [Zn2+]0 = [Cu2+]0
= 1,0.10-2mol.L-1
(concentrations effectives des ions présents dans le pile au départ)
§
Mesurer
l’intensité du courant débité par la pile (1). I
=
2.
Exploitation :
On cherche à prévoir la durée de fonctionnement
Δt de la pile.
§
En
supposant le courant d’intensité I constant pendant toute la durée de
fonctionnement de la pile. Exprimer le nombre d’électrons Ne- mis en
jeu pendant cette durée Δt.
On rappelle que chaque électron porte une quantité d’électricité ![]()
§
En
déduire l’expression de la quantité d’électrons ne-
correspondante :
§
Compléter
le tableau d’avancement :
Remarques :
-
On
appelle V le volume de chaque solution et on le considère identique dans chaque
demi pile
-
une
nouvelle colonne utile au calcul s’ajoute : quantité d’électrons (en mol)
mis en jeu lors de la
transformation
-
on
appelle m0(Zn) et
m0(Cu) les masses initiales des électrodes
de Zinc et de Cuivre inconnues
et donc n0(Zn) et n0(Cu) les quantités
initiales de Zn et de Cu.
-
On
supposera que les lames constituant les pôles de la pile n’ont pas disparu une
fois la pile « vide ».
|
|
|
Qté
d’électrons mis en jeu |
|||
|
x=0 |
[Cu2+]0.V |
|
n0(Cu) |
[Zn2+]0.V |
0 |
|
0 < x < xf |
|
|
|
|
|
|
xf |
|
|
|
|
|
§
Quel
est le réactif limitant. En déduire xf.
§
Montrer
que ![]()
§
En
déduire Δt.
§
Exprimer
en fonction de I, Δt, NA et e les concentrations finales de
chaque espèce ionique lorsque la pile est usée. Calculer ces concentrations.
§
Exprimer
les variations de masses Δm=mf-m0 de chaque
électrode en fonction de I, Δt, NA et e. Calculer ces
variations.