|
CHAPITRE 7Les combustions |
||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
I- Que se passe –t-il lorsque l’on brûle du carbone ?
Le charbon et le fusain sont constitués de 90%à 99% de carbone. Les 1 à 10% restants sont composés de matières incombustibles (des minéraux) , que l’on retrouvent dans les cendres.
1.1. Combustion dans l’air
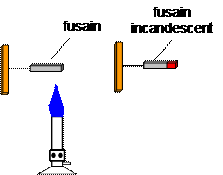
Introduisons un morceau de fusain dans la flamme d’un bec bunsen .
Observation : Dans l’air le fusain reste incandescent quelques instants. La combustion est lente et sans flamme.
1.2. Combustion dans le dioxygène
Remplissons un flacon de dioxygène par déplacement d’eau .Puis introduisons un morceau de fusain incandescent. Fermons le flacon. Observation : Dans le dioxygène de petites flammes entourent le fusain et des étincelles se produisent. La combustion est rapide et dégage beaucoup de chaleur. Interprétation : Le fusain se consume rapidement.
Conclusion : Au cours de la combustion du fusain, le carbone disparaît
VOIR LA VIDEO
1.3. Mise en évidence de la consommation du le dioxygène
Introduisons après la combustion du fusain , une bûchette incandescente. · Observation : Elle s’éteint rapidement · Interprétation : Il n’y a donc plus de dioxygène dans le flacon. · Conclusion : Au cours de la combustion du fusain, le dioxygène disparaît.
VOIR LA VIDEO
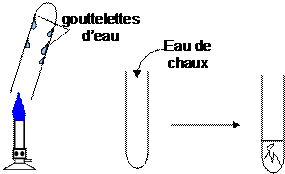
1.4. Mise en évidence de la formation de dioxyde de carbone .
Introduisons de l’eau de chaux et agiter le flacon · Observation : l’eau de chaux se trouble · Interprétation : Il s’est formé du dioxyde de carbone . · Conclusion : Au cours de la combustion du fusain, du dioxyde de carbone apparaît
II- Écriture symbolique d’un bilan
¨Réactifs (de la réaction) : Quel que soit leur état physique (solide, liquide ou gazeux) , les réactifs sont les corps qui disparaissent lorsqu'ils sont mis en réaction. La réaction s'arrête avec la disparition de l'un des réactifs. ¨ Produits (de la réaction) : Quelque soit leur état physique ,les produits sont les nouveaux corps qui apparaissent. ¨ Réaction chimique : Il y a réaction chimique chaque fois qu'un ensemble de phénomènes, spontanés ou provoqués, conduit à la disparition des réactifs et à l'apparition des produits.
¨ Bilan d’une réaction chimique : Le réactif (1) réagit avec le réactif (2) pour former le produit (1) et le produit (2). Cette réaction chimique se représente symboliquement par un bilan : à gauche les réactisf (ce qui disparaît) et à droite les produits ( ce qui apparaît)
Bilan : réactif (1) + réactif (2) ¾® produit (1) + produit (2)
Application : Combustion du carbone 1.Quels sont les réactifs ? 2. Quel(s) est (sont) le(s) produit(s) ? 3. Écrire une phrase résumant la réaction lors de la combustion du carbone . 4. Écrire le bilan de la réaction. SOLUTION
III- Combustion du butane
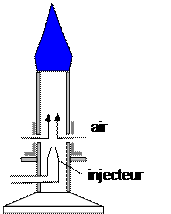
3.1. Utilisation et principe du bec Bunsen
3.2. Combustion complète du butane (mélange riche en dioxygène)
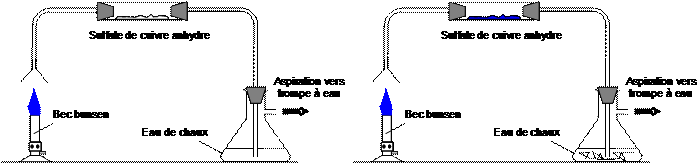
Le butane est le gaz que l'on trouve dans les bouteilles à gaz ou dans les briquets. Le bec bunsen est relié à une bouteille contenant du butane. Réalisons la combustion du butane et plaçons un tube à essai au dessus de la flamme afin de récupérer les gaz de combustion. Introduisons de l’eau de chaux.
· Observation : Au cours de la combustion, le sulfate de cuivre anhydre bleuit et l’eau de chaux se trouble. · Interprétation : Lors de la combustion, il se produit de l’eau et du dioxyde de carbone. ·Conclusion : La combustion du butane dans le dioxygène de l’air est une réaction chimique Bilan de la réaction : butane + dioxygène ¾® eau + dioxyde de carbone
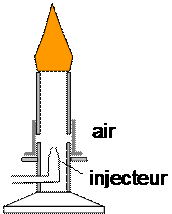
3.3. Combustion incomplète du butane (mélange pauvre en dioxygène)
Plaçons une soucoupe au dessus de la flamme . - Observation : La flamme est lumineuse et dégage de la fumée que l’on peut recueillir avec une soucoupe. Celle-ci se couvre d’un solide noir. - Interprétation : Lors de la combustion incomplète, il se forme en plus du dioxyde de carbone et de l’eau, d’autres produits : du carbone ( solide noir) et du monoxyde de carbone (gaz indécelable car il est incolore et inodore). - Conclusion : La combustion incomplète du butane dans le dioxygène de l’air est une réaction chimique. Cette combustion est dite incomplète car certains des produits qui se forment peuvent encore brûler.
Application : combustion du méthane (Un dispositif particulier)
Afin de mettre en évidence les produits de la combustion du méthane, on utilise le dispositif ci-dessous. La fiole à vide permet d’aspirer les gaz qui se dégagent : ceux-ci traversent alors le sulfate de cuivre anhydre et barbotent dans l’eau de chaux.
1. Précisez le rôle du sulfate de cuivre anhydre et ce lui de l’eau de chaux. 2. Notez vos observations concernant ces deux substances. 3. Déduisez-en le nom des deux produits formés lors de la combustion du méthane.4. Écrire le bilan de la combustion du méthane
SOLUTION
remarques :
- Bilan général d’une combustion :
- Pour qu’une combustion puisse avoir lieu, il faut simultanément : un combustible (essence, papier, bois, bougie, alcool etc ) , un comburant (dioxygène, dioxyde de carbone etc) et une source de chaleur (frottement, flamme, étincelle, compression, court-circuit)
IV- Le danger des combustions
4.1. Les explosions
Dans certaines circonstances certaines combustions deviennent explosives : en un laps de temps, une très grande quantité de gaz est fabriquée engendrant la formation d'une onde de choc qui détruit tout sur son passage. Pour en savoir une peu plus : http://www.cepr.tm.fr/fr/risqdome/explosion.htm
4.1.1.Réaliser une réaction explosive
Des fuites de butane peuvent provoquer de graves explosions. Comment réaliser une réaction explosive ? Expérience à faire UNIQUEMENT par le professeur : Mélanger de l'eau et du liquide vaisselle. Introduire, à l'aide d'une seringue, un mélange de butane et de dioxygène : il se forme des bulles. Enflammer les bulles avec une allumette.
4.1.2. Un mélange air-gaz qui devient explosif
Tous les gaz sont explosifs dès que leur mélange dans l’air atteint une certaine concentration. Pour le butane, elle est comprise entre 1,8 % et 15 %. En dessous de la limite inférieure et au dessus de la limite supérieure, il n’y a pas de risque d’explosion.
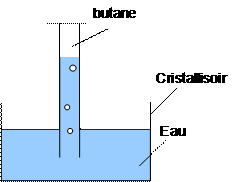
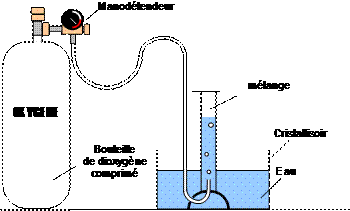
1. Pour 100 L de mélange de gaz, Quel est le nombre de litre de dioxygène ainsi que le nombre de litre de butane mélangé ? 2. Le mélange introduit dans la seringue correspond-il bien à un mélange explosif ? 3.1. Pour réaliser cette expérience, on utilise une cuve à eau dans laquelle on a retourné une éprouvette graduée remplie d’eau. Dessiner le schéma. 3.2. Déterminer le volume de butane qu’il faut introduire dans l’éprouvette sachant que l’on désire préparer 250 mL de mélange explosif. 3.3. On dispose d’un briquet contenant du butane. Expliquer simplement comment recueillir dans l’éprouvette, le volume de butane désiré. 4.1. Quel volume de dioxygène doit-on introduire dans l’éprouvette pour réaliser le mélange explosif 4.2. Comment procède-t-on pour recueillir le volume de dioxygène à l’aide d’une bouteille de dioxygène. Réaliser un dessin.SOLUTION Aide : 2 volumes de butane pour 13 volumes de dioxygène, cela revient à dire que sur 15 litres de mélange formé, on a utilisé 2 litres de dioxygène et 13 litres de dioxygène.
4.1.3. L’enfant qui manipule les boutons de la cuisinière
"NE PAS TOUCHER AU GAZ" est l’un des premiers interdits que l’adulte impose à l’enfant dès qu’il marche. Mais l’enfant peut le déjouer et les circonstances sont différentes selon l’âge. À 18 mois, il le fait par inadvertance. À trois ans, il le fait pour vérifier que l’interdit est toujours de rigueur ou pour le braver en déjouant la vigilance de ses parents. À 6 ans, il le fait pour comprendre comment ça marche. Si la fuite provient d’un brûleur, l’adulte peut rapidement détecter la fuite grâce à l’odeur qui se répand dans l’air ambiant… À condition d’être là ! Si l’enfant manipule le bouton du four et que le gaz se diffuse à l’intérieur, le risque d’explosion est imminent ! L’explosion du four peut survenir aussi bien avec le méthane, le butane ou le propane. Un enfant tourne le bouton d’un brûleur rapide d’une cuisinière à butane. Le débit horaire pour ce gaz est de est de 168 g/h .Le dimensions de la cuisine sont les suivantes 4´2,5´2,5 (mètres).
1. Déterminer le volume de la cuisine 2. Le mélange air-butane devient explosif pour une concentration en butane de 1,8%, en déduire le volume de butane présent dans l’air 3. sachant qu’un litre de butane pèse dans les conditions normales de pression et de température 2,4 g, en déduire la masse de butane en kilogramme contenu dans l’air. 4. Déterminer au bout de combien de temps, l’air de la cuisine devient explosif.SOLUTION
4.2. Les incendies
4.3. Intoxication au monoxyde de carbone ( Article de journal )
En 1994, les combustions incomplètes font la une de la "DEPECHE DU MIDI".
Alerte à l'oxyde de carbone : deux morts et une centaine d'intoxiqués dans le Nord Réchauffement soudain de l'atmosphère, absence de vent, et utilisation des appareils de chauffage au charbon ont créé les conditions idéales à la propagation de l'oxyde de carbone, gaz indétectable et mortel qui a causé, hier, la mort de deux personnes et l'hospitalisation d'une centaine d'autres dans le nord de la France. ( ... )
Attention aux chauffages défectueux ou au ralenti : Quatre-vingt personnes hospitalisées chaque année à Toulouse L'oxyde de carbone (CO) provient de la combustion incomplète des carburants qui en cycle normal se transforment en gaz carbonique (CO2), en eau et en chaleur. Les chaudières et poêles à charbon, encore très répandus dans cette région, sont particulièrement touchés par ce cycle de combustion incomplet, notamment si le charbon est de mauvaise qualité. ( ... )
Pour éviter l'intoxication Ce qu'il faut faire. Faire ramoner sa cheminée une fois par an (C'est obligatoire !...) Vérifier le bon état des conduites d'aération Ce qu'il ne faut pas faire : Boucher les aérations disposées dans les appartements sous prétexte qu'elles laissent passer le froid ; elles laissent aussi passer l'oxygène Installer un chauffe-eau sans cheminée dans une salle de bains sans aération Utiliser un chauffage de fortune (brasero, poêle ...) sans cheminée. Les personnes intoxiquées doivent être placées dans des caissons hyperbare et ventilées en respirant massivement de l'oxygène pour être désintoxiquées. "Ce sont les appareils de chauffage mal réglés, ou les appartements mal aérés qui sont à l'origine des intoxications, parfois mortelles, au monoxyde de carbone.
Premier symptômes : fatigue, nausées .... "L'intoxication au monoxyde de carbone est insidieuse, explique le Docteur Michèle Fabre, parce qu'elle passe tout d'abord inaperçue et qu'ensuite elle ressemble à beaucoup d'autres maladies." La victime ressent d'abord une fatigue, une faiblesse dans les jambes, des maux de tête ... Puis viennent les nausées et les vomissements. Alors on pense souvent à une intoxication d'origine alimentaire, surtout lorsque les membres d'une même famille sont atteints. Vient ensuite la torpeur, une vague somnolence ... "Et on n'a plus le réflexe d'ouvrir la fenêtre pour respirer !" avertit le Commandant Fleury. Aux premiers symptômes un peu suspects, il vaut mieux ouvrir la fenêtre : Si ça va mieux vous saurez à qui vous avez à faire. "Le monoxyde de carbone, qui pénètre dans les poumons se fixe sur les globules rouges trois cents fois mieux que le dioxygène nécessaire à la production d'énergie et au fonctionnement du cerveau et irréversiblement. Il bloque alors le transport du dioxygène dans tout l'organisme, ce qui entraîne d'abord une perte de connaissance, puis la mort par asphyxie. En cas de légère intoxication, il suffit d'ouvrir la fenêtre et de respirer longuement. Pour les cas les plus graves, il faut mettre le patient sous oxygène. A Toulouse nous avons un caisson hyperbare, c'est pourquoi nous traitons les intoxications graves de la région, dit le docteur M. Fabre. Là, les personnes intoxiquées sont ventilées en respirant massivement de l'oxygène."
1. Réécrire la phrase suivante en utilisant un vocabulaire scientifique : « L’oxyde de carbone provient de la combustion …. en eau et en chaleur. » 2. Quels sont les effets du monoxyde de carbone sur le sang ? 3. Pourquoi le monoxyde de carbone est-il dangereux ? 4. Quels sont les risques encourus ? 5. Quelle(s) précaution(s) faut-il prendre pour éviter de tels accidents ? 6. Quels sont les premiers symptômes d’une intoxication au monoxyde de carbone. 7. Quelle est la première mesure d'urgence à mettre en œuvre chaque fois qu'il peut y avoir risque d'intoxication au monoxyde de carbone ? SOLUTION
|